El alto costo y el largo tiempo detrás de llevar un nuevo medicamento al mercado: Una mirada interna a la I+D farmacéutica en números.
La Industria Farmacéutica es el sector industrial que más dinero le inyecta al área de Investigación y desarrollo (I+D), sólo en el año 2022 se gastó 238 billones de dólares.
El costo y el tiempo necesarios para la investigación y desarrollo farmacéutico (I+D) puede variar ampliamente dependiendo del tipo de medicamento que se esté desarrollando y de la etapa de desarrollo en la que se encuentre.
Según un estudio de 2018 del “Tufts Center for the Study of Drug Development”, el costo promedio para desarrollar un nuevo medicamento y llevarlo al mercado es de aproximadamente $2.6 mil millones. El estudio también encontró que el tiempo promedio desde el descubrimiento inicial hasta la aprobación de la FDA es de alrededor de 10 a 15 años.
Sin embargo, estas cifras deben tomarse como estimaciones aproximadas. Los costos y plazos pueden variar mucho dependiendo del tipo de medicamento que se esté desarrollando y las empresas y organizaciones involucradas.
Las Farmacéuticas centran sus desarrollos en diferentes tipos de medicamentos, como por ejemplo:
- Desarrollo de vacunas.
- Desarrollo de medicamentos para enfermedades huérfanas.
- Terapias oncológicas.
- Enfermedades infecciosas.
- Enfermedades Huérfanas: Son aquellas enfermedades, potencialmente mortales y que afectan a una muy pequeña cantidad de personas en el mundo. Este tipo de enfermedades son complejas, como por ejemplo: Enfermedades genéticas, tipos de cáncer poco frecuentes o enfermedades infecciosas. En la UE, una enfermedad es llamada rara cuando afecta a menos de 5 personas por cada 10 000 personas2.
A continuación, se encuentran diferentes cifras que muestran el desarrollo farmacéutico a nivel mundial.
1. Nuevas terapias para los pacientes: un vistazo al número de nuevas sustancias activas aprobadas.
Primero, la I+D farmacéutica es un proceso complejo que requiere mucho tiempo y que involucra una amplia gama de actividades, incluyendo la investigación básica, el desarrollo preclínico, los ensayos clínicos y la aprobación regulatoria. El proceso comienza con la investigación básica para identificar posibles moléculas y desarrollar nuevos compuestos. Esto puede implicar la detección de un gran número de compuestos para identificar aquellos con las propiedades deseadas, y luego la realización de estudios de laboratorio para determinar su seguridad y eficacia.
De esta manera un indicador del progreso farmacéutico es el número de substancias activas aprobadas por año. Para que un nuevo medicamento pueda ser comercializado éste debe ser aprobado por alguna organización regulatoria.
- Substancia Activa o Ingrediente Activo: Es la molécula en un medicamento encargada de generar un efecto directo en la cura, tratamiento o prevención de una enfermedad.
Algunos entes regulatorios son:
- FDA: Food and Drug Administration (USA) – (https://www.fda.gov).
- EMA: European Medicines Agency (Unión Europea) – (https://www.ema.europa.eu/en).
- ANVISA: Agência Nacional de Vigilância Sanitária (Brasil) – (https://www.gov.br/anvisa/pt-br).
- INVIMA: Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Colombia) – (https://www.invima.gov.co)
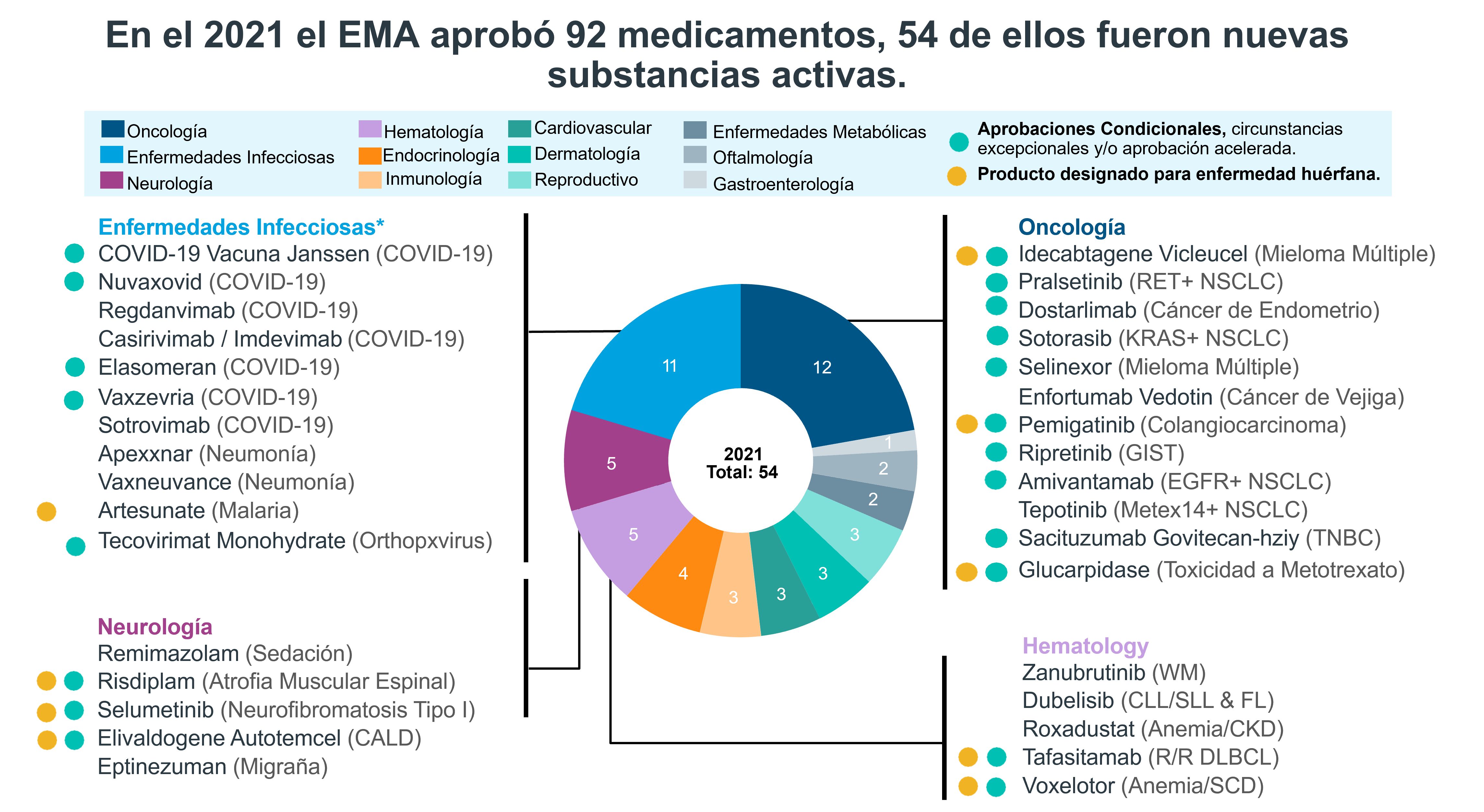
El año 2021 fue el año de los medicamentos nuevos para enfermedades infecciosas debido al virus de SARS-CoV-2. En el 2021 el EMA (European Medicines Agency) aumentó su aprobación de medicamentos en un 28% comparado con el 2020.
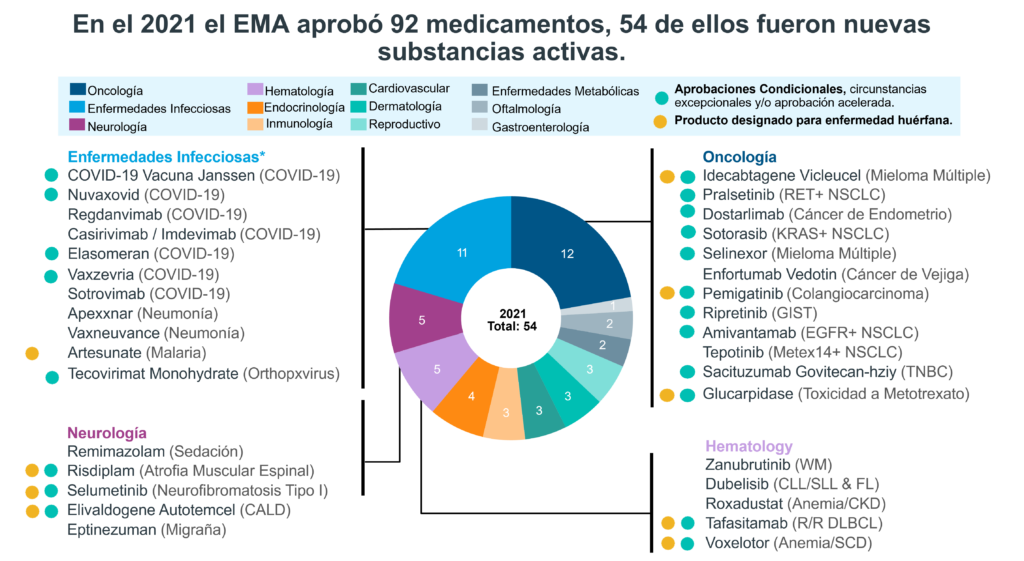
Imagen tomada de: IQVIA | EFPIA Pipeline Innovation Review 2022
2. Seguimiento del crecimiento de los ensayos clínicos: un vistazo al número de ensayos realizados por año.
Ahora bien, una vez que un candidato a un medicamento ha demostrado ser prometedor en estudios preclínicos, pasa a los ensayos clínicos.
Estos ensayos se llevan a cabo en tres fases diferente. Cada fase diseñada para evaluar diferentes aspectos de la seguridad y la eficacia del medicamento.
- Los ensayos de fase I involucran a un pequeño número de voluntarios sanos, entre 15 y 20 pacientes. Están diseñados para evaluar la seguridad del medicamento y los posibles efectos secundarios.
- Los ensayos de fase II involucran a un mayor número de pacientes, aproximadamente 100 pacientes. Están diseñados para evaluar la eficacia del medicamento.
- Los ensayos de fase III son estudios grandes, aleatorizados y controlados que se llevan a cabo para confirmar la eficacia y la seguridad del fármaco, y para generar datos que puedan usarse para apoyar la aprobación regulatoria. Participan miles y hasta hasta cientos de miles pacientes de todo el mundo.
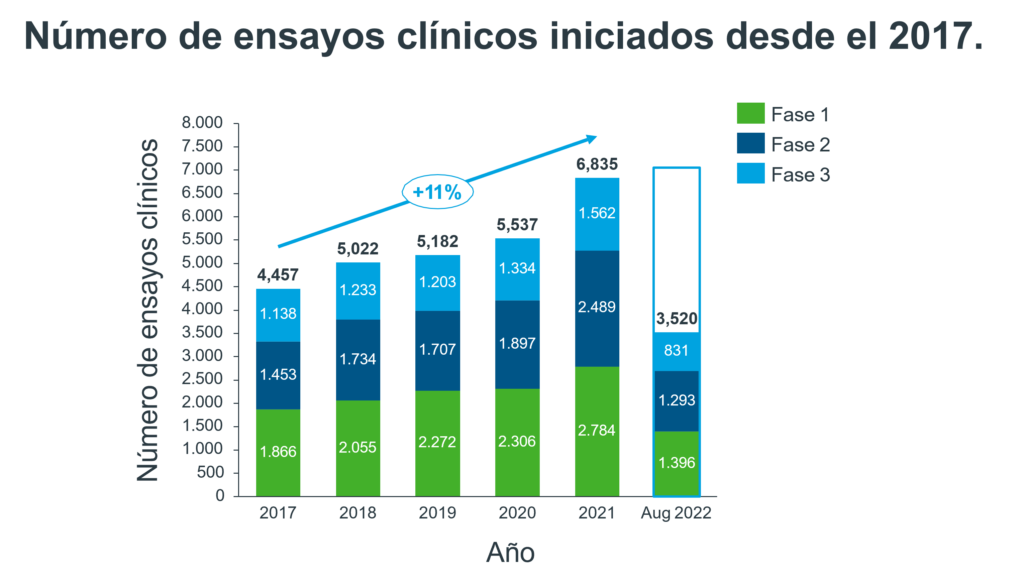
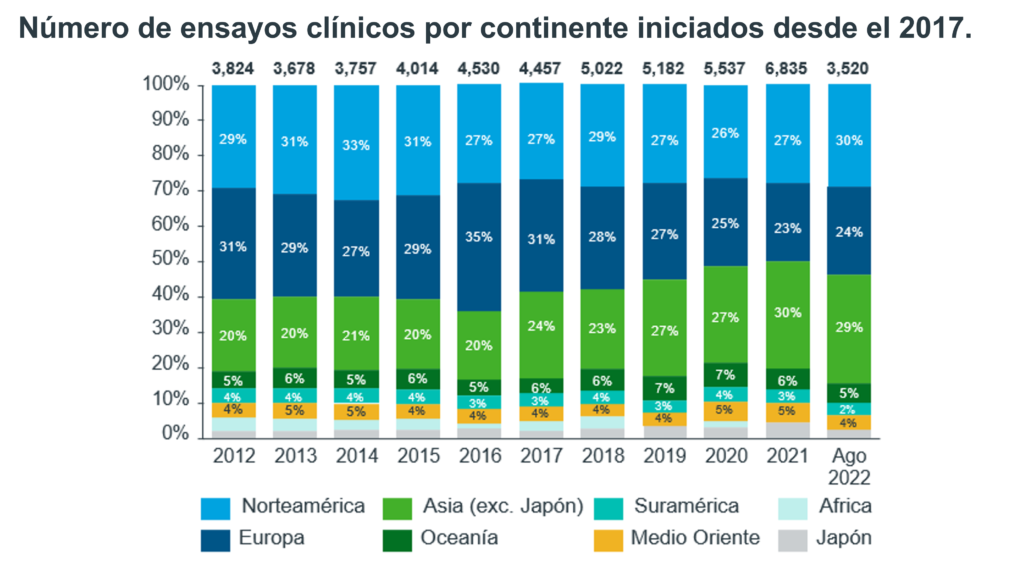
Hasta Agosto del 2022 se habían iniciado 3 520 fases de ensayos clínicos. Las áreas médicas en donde mas se iniciaron ensayos clínicos fueron: Oncología, Enfermedades Infecciosas, Neurología, Hematología y Endocrinología.
Una vez completados los ensayos clínicos, la empresa dueña del medicamento presenta una Solicitud de Nuevos Medicamentos (NDA) o una Solicitud de Licencia de Productos Biológicos (BLA) a la agencia reguladora pertinente, como la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) o la Agencia Europea de Medicamentos (EMA), para su revisión y aprobación.
Sin embargo, el proceso de revisión puede tardar varios meses o incluso años, y la agencia puede requerir información o estudios adicionales antes de aprobar el medicamento.
2.1 Explorando la distribución de los ensayos clínicos en los continentes: dónde está ocurriendo la investigación clínica.
La distribución de los ensayos clínicos en los diferentes continentes puede variar dependiendo de una serie de factores, incluyendo la disponibilidad de fondos, infraestructura y poblaciones de pacientes.
América del Norte (Estados Unidos y Canadá) y Europa se consideran centros importantes para los ensayos clínicos, con un número significativo de ensayos que tienen lugar en estas regiones. Según un informe de 2019 del Centro Tufts para el Estudio del Desarrollo de Medicamentos, más de la mitad de todos los ensayos clínicos se llevaron a cabo en estas dos regiones.
En América del Norte, la mayoría de los ensayos clínicos se realizan en los Estados Unidos, que tiene una población grande y diversa y un sistema regulador bien establecido. Según los datos de ClinicalTrials.gov, en 2021, Estados Unidos tenía el mayor número de ensayos clínicos registrados de cualquier país del mundo, con más de 200.000 ensayos.
En Europa, la mayoría de los ensayos clínicos se realizan en países de Europa occidental, como el Reino Unido, Alemania y Francia. Según los datos de la Base de Datos Europea de Ensayos Clínicos, en 2021, estos países tenían los mayores números de ensayos clínicos registrados de Europa.
3. Una mirada mas profunda en las áreas terapéuticas clave en I+D farmacéutica
Las empresas farmacéuticas centran sus esfuerzos de investigación y desarrollo en una amplia gama de áreas de terapia. Esto con el objetivo de desarrollar nuevos tratamientos para una variedad de enfermedades. Algunas de las áreas terapéuticas clave para la I+D en la industria farmacéutica incluyen:
3.1 Ejemplos de áreas terapéuticas clave en I+D farmacéutica.
- Cáncer: Es un foco importante de I+D farmacéutica desde hace muchos años. Las empresas se centran en una amplia gama de tipos de cáncer, incluyendo el cáncer de mama, pulmón y próstata.
- Enfermedades cardiovasculares: Son una de las principales causas de muerte en todo el mundo. Es clave prevenir y manejar estas afecciones como la insuficiencia cardíaca, hipertensión e hiperlipidemia.
- Neurología: La neurología es otra área de terapia clave para la I+D en la industria farmacéutica. Los trastornos neurológicos de mayor interés son la enfermedad de Alzheimer, la enfermedad de Parkinson y la esclerosis múltiple.
- Enfermedades metabólicas: Las enfermedades metabólicas, como la diabetes y la obesidad, son cada vez más frecuentes en todo el mundo. Las empresas farmacéuticas están trabajando para desarrollar nuevos tratamientos para manejar estas condiciones.
- Inmunología: Con la creciente comprensión del sistema inmunológico, las empresas farmacéuticas desarrollan terapias para enfermedades autoinmunes, alergias y trasplantes.
- Enfermedades infecciosas: La investigación de enfermedades infecciosas es otra área clave para la I+D farmacéutica. Algunas enfermedades de interés son el VIH, la gripe y la malaria.
- Medicamentos huérfanos: Los medicamentos huérfanos son medicamentos desarrollados para tratar enfermedades raras. A menudo son pasados por alto por las compañías farmacéuticas porque afectan solo a poblaciones de pacientes pequeñas.
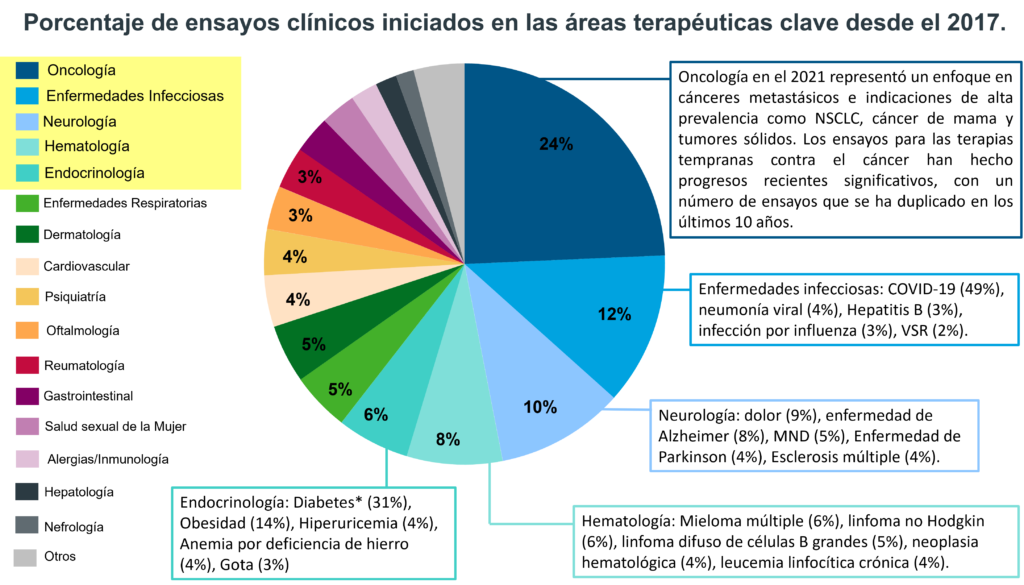
Estos son solo algunos ejemplos de las muchas áreas de terapia en las que las compañías farmacéuticas centran sus esfuerzos de I+D, así como la investigación en medicina personalizada y terapia génica. La elección del área de terapia es impulsada por una combinación de factores, incluyendo las necesidades médicas insatisfechas, la ciencia detrás de la enfermedad y el entorno regulatorio.
Conclusión
Finalmente, el proceso de I+D farmacéutico es largo, complejo y costoso y requiere recursos significativos por las partes interesadas.
América del Norte y Europa son centros importantes para los ensayos clínicos, con un número significativo de ensayos en estas regiones. Asia y América Latina también se están convirtiendo en centros cada vez más importantes para los ensayos clínicos.
En resumen, la I+D farmacéutica es un proceso complejo y costoso que requiere importantes recursos y experiencia. Es importante considerar los costos, plazos y distribución de los ensayos clínicos al evaluar el estado de la I+D. El número de nuevas sustancias activas aprobadas es también una medida importante para seguir el éxito de la I+D.
Referencias:
1. Worldwide pharmaceutical R&D spending 2014-2028 | Statista. https://www.statista.com/statistics/309466/global-r-and-d-expenditure-for-pharmaceuticals/.
2. COMISIÓN EUROPEA DIRECCIÓN GENERAL DE SANIDAD Y PROTECCIÓN DE LOS CONSUMIDORES.
3. IQVIA/EFPIA Pipeline Review 2021. https://www.efpia.eu/publications/downloads/efpia/iqviaefpia-pipeline-review-2021/.
4. Tufts CSDD. https://csdd.tufts.edu/.
